Wir enthüllen die Geheimnisse von Gehirnkrankheiten – wenn Proteine in Feststoffen stecken bleiben
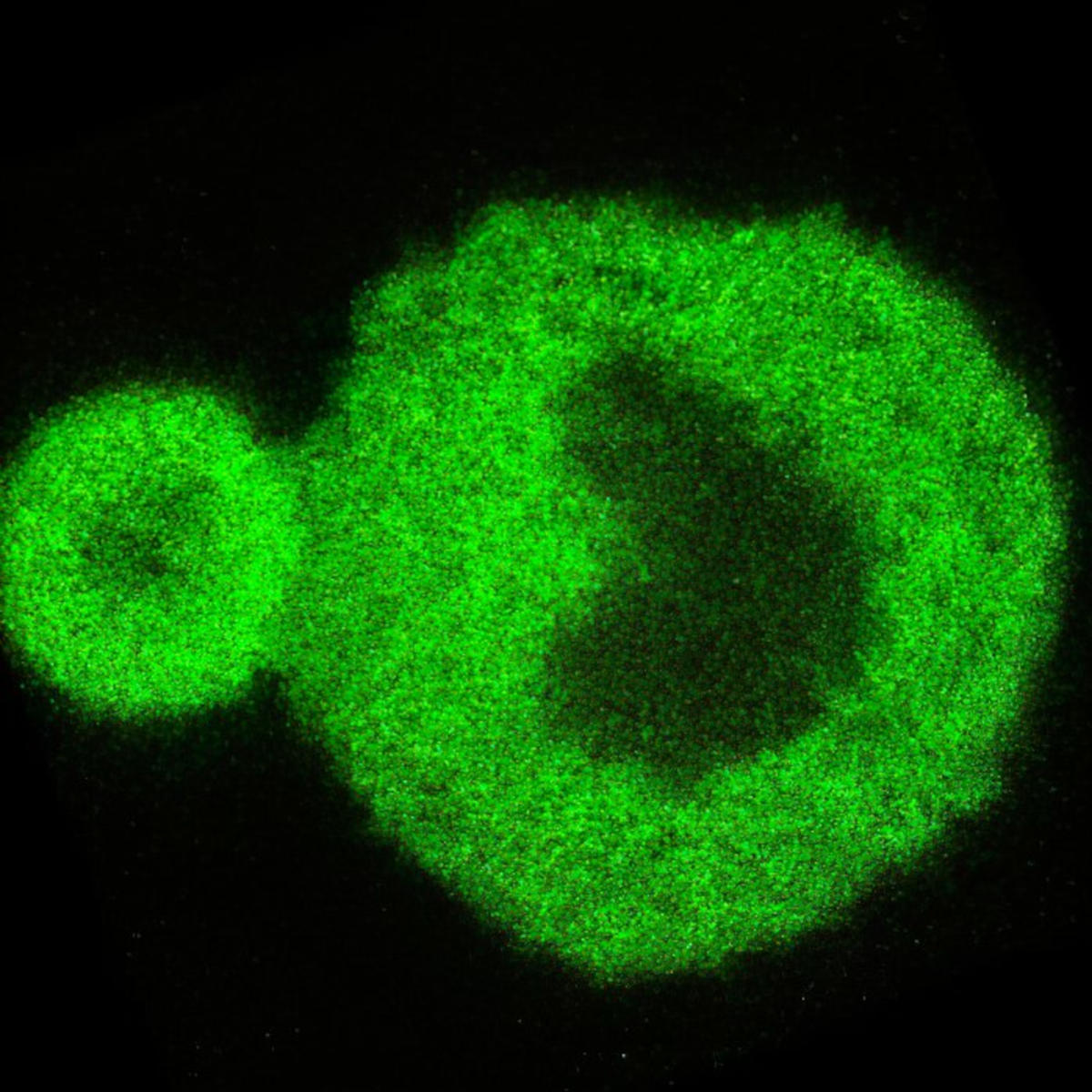

Die Forscher verwendeten fortschrittliche optische Techniken, um die Bildung von Proteinaggregaten im Zusammenhang mit neurodegenerativen Erkrankungen zu untersuchen. Durch die Analyse eines mit ALS verbundenen Proteins gewannen sie beispiellose Einblicke in den Übergang des Proteins vom flüssigen in den festen Zustand und gaben Aufschluss über Erkrankungen wie die Alzheimer-Krankheit und ALS. Oben ist ein Nanoscan-Bild, das eine Proteinkondensationsreaktion zeigt. Bildnachweis: University of Sydney
Die Betrachtung von Proteinen im Nanomaßstab liefert Erkenntnisse für die Behandlung neurodegenerativer Erkrankungen.
Viele Krankheiten, die das Gehirn und das Nervensystem betreffen, sind mit der Bildung von Proteinaggregaten oder festen Kondensaten in Zellen aus ihren flüssigen Kondensaten verbunden, über diesen Prozess ist jedoch wenig bekannt.
Dieser Übergang von flüssig zu fest kann zur Bildung sogenannter Amyloidfibrillen führen. Diese können Plaques in Nervenzellen bilden und neurodegenerative Erkrankungen verursachen wie: Alzheimer-Erkrankung.
Biomedizinische Ingenieure der University of Sydney haben in Zusammenarbeit mit Wissenschaftlern der University of Cambridge und der Harvard University hochentwickelte optische Techniken entwickelt, um den Prozess, durch den diese Proteinaggregate gebildet werden, aus nächster Nähe zu überwachen.
Durch den Test eines Proteins, das mit der Krankheit Amyotrophe Lateralsklerose (ALS) in Zusammenhang steht, von der der Astrophysiker Professor Stephen Hawking betroffen ist, haben Ingenieure aus Sydney den Übergang von der flüssigen in die feste Phase genau überwacht.
Konfokale 3D-Rastermikroskopie von FUS-Proteinkondensat, das 24 Stunden lang inkubiert wurde, zeigt die charakteristische Kern-Kortex-Struktur, die durch diese Forschung aufgedeckt wurde. Kredit: f Universität Sydney
„Dies ist aus grundlegender Sicht ein großer Schritt vorwärts zum Verständnis der Entwicklung neurologischer Erkrankungen“, sagte Dr. Yi Xin, Hauptautor der in der Fachzeitschrift Neurology veröffentlichten Studie. Verfahren der Nationalen Akademie der Wissenschaften (PNAS) in den Vereinigten Staaten.
„Wir können jetzt den Übergang dieser wichtigen Proteine vom flüssigen in den festen Zustand direkt beobachten nanoskalig „Es ist ein Millionstel Meter“, sagte Dr. Daniel Figullo, Dozent an der School of Biomedical Engineering und Mitglied des Nano Institute der University of Sydney.
Proteine bilden während der Flüssig-Flüssig-Phasentrennung regelmäßig Kondensate bei einer Vielzahl kritischer und gesunder biologischer Funktionen, beispielsweise bei der Bildung menschlicher Embryonen. Dieser Prozess unterstützt biochemische Reaktionen, bei denen Proteinkonzentrationen entscheidend sind, und fördert außerdem gesunde Protein-Protein-Wechselwirkungen.

Das Forschungsteam von Vigolo und Shane. Bildnachweis: University of Sydney
„Dieser Prozess erhöht jedoch auch das Risiko einer dysfunktionalen Aggregation, wodurch sich in menschlichen Zellen ungesunde Aggregate starrer Proteine bilden“, sagte Dr. Shen, ARC DECRA Fellow an der School of Chemical and Biomolecular Engineering und Mitglied von Sydney Nano. .
„Dies kann zu abnormalen Strukturen im Zusammenhang mit neurodegenerativen Erkrankungen führen, da die Proteine keine schnelle Reversibilität mehr in die flüssige Form zeigen. Daher ist es notwendig, die Dynamik der Kondensatoren zu überwachen, da sie Krankheitszustände direkt beeinflussen“, sagte sie.
Durch die weltweit erste optische Beobachtung dieses Prozesses im Nanomaßstab konnte das Team feststellen, dass der Übergang von einem flüssigen Protein zu einem festen Protein an der Grenzfläche der Proteinadsorbate beginnt. Dieses Fenster in den Übergang zeigte auch, dass die inneren Strukturen dieser Proteinaggregate heterogen sind, da sie zuvor als homogen galten.
Dr. Vigolo sagte: „Unsere Ergebnisse versprechen, unser Verständnis neurologischer Erkrankungen aus einer grundlegenden Perspektive erheblich zu verbessern.“
„Dies bedeutet ein vielversprechendes neues Forschungsgebiet, um besser zu verstehen, wie die Alzheimer-Krankheit und ALS im Gehirn fortschreiten und Millionen von Menschen weltweit betreffen.“
Referenz: „Der FUS-Übergang von Flüssigkeit zu Feststoff wird durch Oberflächenkondensat verbessert“ von Yi Shen, Anqi Chen, Wenyun Wang, Yinan Shen, Francesco Simone Ruggeri, Stefano Aime, Zizhao Wang, Seema Qamar, Jorge R. Espinosa, Adiran Garrizar, verfügbar Hier. Peter St. George Heslop, Rosanna Colibardo Guevara, David A. Weitz, Danielle Figullo und Thomas PJ Knowles, 7. August 2023, hier verfügbar. Verfahren der Nationalen Akademie der Wissenschaften.
doi: 10.1073/pnas.2301366120
Die Studie wurde von der Francis and Augustus Newman Foundation, dem Wellcome Trust, dem European Research Council, der American Alzheimer’s Association, ALS Canada-Brain Canada, den Canadian Institutes of Health Research und dem National Institute on Aging finanziert.

„Musikfan. Sehr bescheidener Entdecker. Analytiker. Reisefreak. Extremer Fernsehlehrer. Gamer.“